· Ілля Добрий · ГДЗ · 6 хв. читати
§19. Вуглекислий газ
Вправа 19.1. Схарактеризуйте фізичні властивості газу, заповнивши таблицю.
| Характеристика | Опис |
|---|---|
| Хімічна формула | CO₂ |
| Відносна молекулярна маса | Mr(CO₂) = 44 |
| Колір, запах | Безбарвний, без запаху |
| Агрегатний стан за звичайних умов | Газоподібний |
| Температура кипіння | –56,6 °С (за тиску 5 атм) |
| Температура плавлення | –78,5 °С (за тиску 1 атм) |
| Розчинність у воді | Добре розчиняється |
| Густина | 1,977 г/л |
| Значення в природі | Вихідна речовина (реагент) фотосинтезу |
Вправа 19.2. Схарактеризуйте способи одержання вуглекислого газу, заповнивши таблицю.
| Процес | Хімічне рівняння | Умови перебігу |
|---|---|---|
| Горіння вугілля (або сажі) | C + O₂ = CO₂ | Нагрівання |
| Горіння метану й інших вуглеводнів | CH₄ + 2O₂ = CO₂ + 2H₂O | Нагрівання |
| Розкладання кальцій карбонату | CaCO₃ = CaO + CO₂↑ | Сильне нагрівання (t ≈ 1000 °C) |
| Реакція харчової (питної) соди з кислотою | NaHCO₃ + HCl = NaCl + CO₂↑ + H₂O | Звичайні умови |
| Реакція кальцинованої соди з кислотою | Na₂CO₃ + H₂SO₄ = Na₂SO₄ + CO₂↑ + H₂O | Звичайні умови |
| Реакція кальцій карбонату з кислотою | CaCO₃ + 2HCl = CaCl₂ + CO₂↑ + H₂O | Звичайні умови |
Вправа 19.3.
| Хімічні рівняння | Умови перебігу |
|---|---|
| Реакція з водою | |
| CO₂ + H₂O = H₂CO₃ | За звичайних умов |
| Реакція з основними оксидами | |
| CO₂ + Na₂O = Na₂CO₃ | За звичайних умов |
| CO₂ + CaO = CaCO₃ | За звичайних умов |
| Реакції з лугами (основами) | |
| Ca(OH)₂ + CO₂ = CaCO₃↓ + H₂O | За звичайних умов |
| 2NaOH + CO₂ = Na₂CO₃ + H₂O | За звичайних умов |
Вправа 19.4. Порівняйте розчинність кисню з розчинністю вуглекислого газу. У якого газу максимальна масова частка в розчині більша? Поставте відповідні знаки.
Вправа 19.5. Обчисліть максимальний об’єм вуглекислого газу, який розчиняється у воді об’ємом 1 л (н.у.). Порівняйте його з розчинністю за 25 °С, якщо густина вуглекислого газу за такої температури 1,8 г/л.
Дано:
V(H₂O) = 1 л
ρ₁(CO₂) = 1,977 г/л (за 0 °C)
ρ₂(CO₂) = 1,8 г/л (за 25 °C)
m₁(CO₂) = 1,73 г
m₂(CO₂) = 1,45 г
Обчислити:
Порівняти об’єми V₁(CO₂) та V₂(CO₂)
Розв’язання:
V₁(CO₂) = 1,73 г : 1,977 г/л ≈ 0,875 л
V₂(CO₂) = 1,45 г : 1,8 г/л ≈ 0,806 л
Порівняння: 0,875 л > 0,806 л.
Відповідь: Із підвищенням температури розчинність газу зменшується.
Вправа 19.6. Запишіть хімічні рівняння реакцій горіння етану С₂Н₆ та пропану С₃Н₈, якщо продукти цих реакцій такі самі, як і під час згоряння метану.
2C₂H₆ + 7O₂ = 4CO₂ + 6H₂O
C₃H₈ + 5O₂ = 3CO₂ + 4H₂O
Вправа 19.7. Запишіть хімічні рівняння реакцій вуглекислого газу з:
а) магній оксидом: MgO + CO₂ = MgCO₃
б) натрій оксидом: Na₂O + CO₂ = Na₂CO₃
в) натрій гідроксидом: 2NaOH + CO₂ = Na₂CO₃ + H₂O
г) барій гідроксидом: Ba(OH)₂ + CO₂ = BaCO₃↓ + H₂O
Вправа 19.8 (Бланки для розв’язування задач №233-237)
Задача № 233
Дано:
V(CO₂) = 1,12 м³ = 1120 л
Обчислити:
m(CaCO₃) — ?
Розв’язання:
n(CO₂) = V(CO₂) : Vm = 1120 л : 22,4 л/моль = 50 моль.
Рівняння реакції: CaCO₃ = CaO + CO₂↑.
Співвідношення n(CaCO₃) : n(CO₂) = 1 : 1, тому n(CaCO₃) = 50 моль.
M(CaCO₃) = 100 г/моль.
m(CaCO₃) = 50 моль - 100 г/моль = 5000 г = 5 кг.
Відповідь: 5 кг кальцій карбонату.
Задача № 234
Дано:
m(NaHCO₃) = 10 г
Обчислити:
m(HCl) — ?, V(CO₂) — ?
Розв’язання:
M(NaHCO₃) = 84 г/моль, M(HCl) = 36,5 г/моль.
n(NaHCO₃) = 10 г : 84 г/моль ≈ 0,119 моль.
Рівняння реакції: NaHCO₃ + HCl = NaCl + H₂O + CO₂↑.
n(NaHCO₃) : n(HCl) : n(CO₂) = 1 : 1 : 1, тому n(HCl) = n(CO₂) = 0,119 моль.
m(HCl) = 0,119 моль · 36,5 г/моль ≈ 4,34 г.
V(CO₂) = 0,119 моль · 22,4 л/моль ≈ 2,67 л.
Відповідь: Потрібно 4,34 г HCl, при цьому утворюється 2,67 л CO₂.
Задача № 235
Дано:
V(повітря) = 45 м³ = 45000 л; φ(CO₂) = 0,056%
Обчислити:
m(Ca(OH)₂) — ?
Розв’язання:
V(CO₂) = 45000 л · 0,056 : 100 = 25,2 л.
n(CO₂) = 25,2 л : 22,4 л/моль = 1,125 моль.
Рівняння реакції: Ca(OH)₂ + CO₂ = CaCO₃↓ + H₂O.
n(Ca(OH)₂) = n(CO₂) = 1,125 моль.
M(Ca(OH)₂) = 74 г/моль.
m(Ca(OH)₂) = 1,125 моль · 74 г/моль = 83,25 г.
Відповідь: Потрібно 83,25 г кальцій гідроксиду.
Задача № 236
Дано:
m(CO₂) = 1 кг = 1000 г
Обчислити:
m(CaO) — ?
Розв’язання:
M(CO₂) = 44 г/моль, M(CaO) = 56 г/моль.
n(CO₂) = 1000 г : 44 г/моль ≈ 22,73 моль.
Рівняння реакції: CaO + CO₂ = CaCO₃.
n(CaO) = n(CO₂) = 22,73 моль.
m(CaO) = 22,73 моль · 56 г/моль ≈ 1273 г = 1,273 кг.
Відповідь: Потрібно ≈1,27 кг кальцій оксиду.
Задача № 237
Дано:
V(CH₄) = 560 л
Обчислити:
m(CaCO₃) — ?
Розв’язання:
n(CH₄) = 560 л : 22,4 л/моль = 25 моль.
Горіння метану: CH₄ + 2O₂ = CO₂ + 2H₂O.
n(CO₂) = n(CH₄) = 25 моль.
Одержання карбонату: CO₂ + Ca(OH)₂ = CaCO₃
n(CaCO₃) = n(CO₂) = 25 моль.
M(CaCO3) = 100 г/моль
m(CaCO₃) = 25 моль · 100 г/моль = 2500 г = 2,5 кг.
Відповідь: Можна одержати 2,5 кг кальцій карбонату.
Вправа 19.9. Проаналізуйте будову вогнегасників і дайте відповіді на запитання.
1. Поясніть значення вуглекислого газу для пожежогасіння, зважаючи на трикутник вогню.
Він важчий за повітря, тому перекриває доступ кисню до вогню, а також сильно охолоджує зону горіння при випаровуванні.
2. Опишіть принцип дії вуглекислотного вогнегасника.
Скраплений газ під тиском виходить назовні, різко розширюється і перетворюється на «сніг» з температурою близько -70°С, який гасить полум’я.
3. За інструкцією не можна триматися руками за патрубок. Поясніть цю вимогу.
Через дуже низьку температуру газу (-70°С) можна отримати сильне обмороження рук.
4. Опишіть принцип дії повітряно-пінного вогнегасника.
Кислота реагує з содою, утворюється вуглекислий газ, який спінює розчин і виштовхує його назовні.
5. Яка функція піноутворювача в повітряно-пінному вогнегаснику?
Створює стійку плівку (піну), яка накриває палаючу речовину і перекриває доступ кисню.
Вправа 19.10
1. Які фізичні явища відбуваються під час декофеїнізації?
Розчинення (екстракція) кофеїну в рідкому CO₂, випаровування CO₂, кристалізація кофеїну.
2. Які способи розділення сумішей застосовують?
Екстракція, фільтрування, випарювання.
3. У додаткових джерелах знайдіть інформацію, у яких ще галузях з подібною метою використовують скраплений вуглекислий газ.
Фармацевтика (виготовлення ліків), парфумерія (вилучення ароматів), харчова промисловість (екстракти спецій).
Вправа 19.11
1. Запропонуйте схему приладу для цього експерименту.
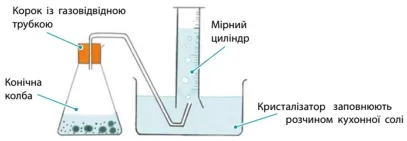
2. За який час прореагувала вся кислота?
За 5 хвилин (згідно з графіком/даними умови).
3. Які змінні тепер вони мають контролювати в цьому експерименті?
Час (хвилини) та об’єм виділеного газу (мл).
4. Більше чи менше газу буде зібрано в другому експерименті? Відповідь поясніть.
Об’єм буде таким самим, оскільки кількість реагентів не змінилася (закон збереження маси). Зміниться лише швидкість.
5. Припустіть, менший чи більший час знадобиться, щоб витратилася вся кислота. Відповідь поясніть.
Час буде меншим, оскільки підвищення температури пришвидшує хімічні реакції.
6. Запропонуйте спосіб, у який можна перевірити це припущення.
Провести дослід із секундоміром за різних температур і порівняти графіки.
Вправа 19.12
1. Опишіть призначення кожного елемента цього приладу.
Свічка — джерело продуктів горіння (CO₂ і H₂O); лійка — для збирання газів; U-подібна трубка (з осушувачем) — для поглинання/конденсації водяної пари; газовідвідна трубка — транспортує газ; пробірка з вапняною водою — індикатор для виявлення вуглекислого газу (мутніє).
2. Після запалення свічки… прилад не працює. Поясніть, у чому було припущено помилку в конструкції.
Пробірка з вапняною водою розміщена нижче від рівня склянки з водою
3. Як можна змінити конструкцію приладу, щоб він запрацював?
Підняти пробірку з вапняною водою на рівень склянки з водою.
Вправа 19.13
1. Навіщо в цей прилад додали осушувач?
Щоб поглинути водяну пару, яка є домішкою. Без цього маса отриманого газу буде неточною (завищеною).
2. Якої помилки припустився Артем?
Не переконався, що вуглекислий газ повністю витіснив повітря з колби.
3. Порівняйте густину вуглекислого газу, отриману Сніжаною, із довідниковою. Чому дані не збігаються? У чому припустилася помилки Сніжана?
Не врахувала масу повітря, яке було в колбі до заповнення газом (колба не була порожньою).
4. Порівняйте густину вуглекислого газу, отриману Артемом і Юлею, із довідниковою. Чи можна впевнено визначити, хто з них акуратніше виконав експеримент?
Виконала експеримент найакуратніше, її результат близький до довідникового.
5. Чим пояснюється розбіжність результату Артема з довідниковим?
Газ не повністю заповнив об’єм (суміш повітря і CO₂ легша за чистий CO₂).
6. Чи можна вважати результат Юлі помилковим? Чому?
Не є помилковим, оскільки незначні відхилення допустимі в межах похибки шкільного експерименту.
Оцініть матеріал
Натисніть на зірку для оцінки:
Коментарі
Залишити відповідь:
Ваша e-mail адреса не оприлюднюватиметься