· Ілля Добрий · ГДЗ · 5 хв. читати
9. Кисень: фізичні властивості та одержання - відповіді Григорович
9.1. Схарактеризуйте властивості кисню, заповнивши таблицю
Звісно, ось заповнена таблиця з характеристиками кисню.
| Характеристика | Опис |
|---|---|
| Хімічна формула | |
| Відносна молекулярна маса | |
| Колір, запах | Не має кольору та запаху |
| Агрегатний стан за звичайних умов | Є газом |
| Температура кипіння | |
| Температура плавлення | |
| Розчинність у воді | Погано розчиняється у воді |
| Густина | трохи важчий за повітря. |
| Значення в природі | Потрібен для дихання більшості живих організмів і для процесів горіння. |
9.2. У двох закритих посудинах містяться повітря і кисень. Як можна визначити, у якій із посудин міститься який газ, не відкорковуючи їх?
Зважити колби на чутливих терезах. Оскільки кисень важчий за повітря, колба з ним буде важчою.
9.3. Запишіть хімічні рівняння одержання кисню розкладанням наведених речовин і зазначте умови перебігу реакцій
а) меркурій(II) оксиду . Нагрівання.
б) бертолетової солі (калій хлорату) . Нагрівання в присутності каталізатора — манган() оксиду ().
в) калій перманганату . Нагрівання.
г) води . Пропускання електричного струму (електроліз).
9.5. Бланки для розв’язування задач № 76-79 підручника (с. 73). У кожному бланку підпишіть номер задачі відповідно до інструкцій учителя / учительки.
76. Обчисліть, у скільки разів густина кисню більша за густину повітря. (Для обчислень використайте дані з параграфа).
Густина кисню за нормальних умов становить , а повітря – .
Щоб обчислити, у скільки разів кисень важчий, потрібно розділити його густину на густину повітря:
Отже, кисень приблизно в раза важчий за повітря.
77. У хімічну склянку налили розчин гідроген пероксиду масою 400 г і додали дрібку манган(ІУ) оксиду. Після завершення виділення бульбашок газу в склянці залишилася вода масою 375 г. Обчисліть: а) масу утвореного кисню; б) масову частку гідроген пероксиду в початковому розчині.
Відомо:
Обчислити:
Розв’язання:
а) Маса утвореного кисню дорівнює різниці мас початкового розчину і рідини після реакції:
б) Згідно з рівнянням реакції , з утворюється .
Знайдемо масу гідроген пероксиду, що розклався для утворення кисню:
Тепер обчислимо масову частку гідроген пероксиду в розчині:
Масова частка гідроген пероксиду в початковому розчині становить приблизно .
78. Порівняйте масові частки Оксигену в калій перманганаті та бертолетовій солі.
Для порівняння обчислимо масові частки () Оксигену.
Молярні маси:
Бертолетова сіль ():
, або .
Калій перманганат ():
, або .
Масова частка Оксигену трохи вища в калій перманганаті.
79. Обчисліть масу кисню, який можна одержати з: а) бертолетової солі масою 1 кг; б) калій перманганату масою 1 кг. Яку із цих двох речовин вигідніше використовувати для одержання кисню (якщо припустити, що в них однакова вартість)? Обчисліть об’єми одержаного кисню в кожному разі (за температури 0 °С й нормального атмосферного тиску).
а) Обчисліть масу кисню, який можна одержати з бертолетової солі масою кг; Обчисліть об’єм одержаного кисню.
Відомо:
кг г
г/л
Обчислити:
- ?
- ?
Розв’язання
Рівняння реакції:
г/моль
г/моль
моль
З рівняння реакції:
, звідси
моль
г
л
Відповідь: г, л.
б) Обчисліть масу кисню, який можна одержати з калій перманганату масою кг. Обчисліть об’єм одержаного кисню.
Відомо:
кг г
г/л
Обчислити:
- ?
- ?
Розв’язання
Рівняння реакції:
г/моль
моль
З рівняння реакції:
, звідси
моль
г
л
Відповідь: г, л.
За однакової вартості вигідніше використовувати бертолетову сіль, оскільки з неї утворюється значно більше кисню.
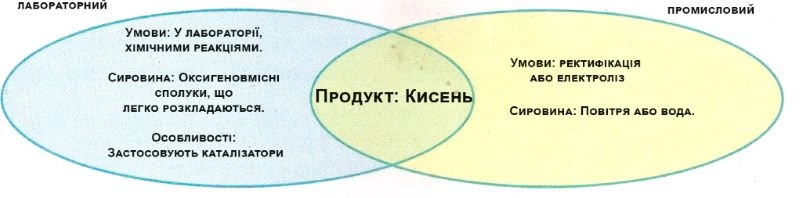
9.6. Складіть діаграму Венна, порівнявши способи одержання кисню:
9.7. Поліна та Сергій досліджували залежність розчинності кисню у воді від температури. За результатами роботи вони накреслили графік. Проаналізуйте графік і дайте відповіді на запитання.
Схарактеризуйте залежність розчинності кисню у воді від температури.
Розчинність кисню у воді зменшується з підвищенням температури.
У водах якого океану — Північного Льодовитого чи Індійського — уміст кисню більший? Аргументуйте свою думку.
Уміст кисню більший у водах Північного Льодовитого океану. Води значно холодніші за води Індійського океану, а в холодній воді, як показує графік, розчиняється більше кисню.
Визначте оптимальну температуру в акваріумі, якщо для життєдіяльності риб мінімальний уміст кисню — 8 мг на 1 л води.
Згідно з графіком, уміст кисню 8 мг/л відповідає температурі приблизно 27,5°C.
Як підвищення температури води в озері внаслідок глобального потепління може вплинути на популяцію риб? Які наслідки глобального потепління на екологічний баланс у водоймах?
Призведе до зниження концентрації розчиненого кисню, що ускладнить дихання риб. Це може спричинити хвороби, уповільнення росту і навіть загибель рибних популяцій. Порушення екологічного балансу також може проявлятися у «цвітінні» води через розмноження водоростей, що ще більше зменшить кількість кисню.
Як температура може впливати на якість питної води, зокрема на наявність патогенних анаеробних мікроорганізмів?
Вища температура води створює сприятливі умови для розмноження мікроорганізмів, у тому числі хвороботворних. Тепла вода містить менше кисню, це сприяє розвитку анаеробних мікроорганізмів, які не потребують кисню і можуть бути небезпечними для здоров’я.
За результатами дослідження Сергій зробив висновок, що в Північному Льодовитому океані найбільше біорізноманіття з-поміж усіх океанів. Оцініть правильність цього твердження, наведіть аргументи для його підтвердження або спростування.
Це твердження є неправильним. Хоча в холодній воді багато кисню, біорізноманіття залежить і від інших факторів, як-от температура, сонячне світло та доступність їжі.
Поліна стверджує, що навіть за покриття водойми льодом, узимку в озері риби зможуть вижити. Оцініть правильність цього твердження, наведіть аргументи «за» або «проти».
Твердження Поліни правильне. Під льодом вода має температуру близько +4°C, за якої вона містить достатньо кисню. До того ж, у холоді метаболізм риб сповільнюється, і вони потребують менше кисню для дихання.
9.8 Дайте аргументовані відповіді щодо способів зберігання кисню (завдання № 94 у підручнику на с. 77).
Як ви вважаєте, у яких посудинах зберігають газуватий кисень, а в яких — скраплений?
Газуватий кисень зберігають у сталевих балонах під тиском. Скраплений — у посудинах Дьюара, що забезпечують теплоізоляцію.
За схемою влаштування посудини Дьюара поясніть, на чому ґрунтується зберігання кисню в необхідному агрегатному стані.
Вона має подвійні стінки з вакуумом між ними. Вакуум погано проводить тепло, тому рідина всередині довго залишається холодною.
Які є обмеження використання посудин Дьюара? За потреби зверніться до додаткових джерел інформації.
Кришка посудини не закривається щільно. Це зроблено спеціально, щоб випускати газ, який утворюється через повільне кипіння рідини всередині, і запобігти небезпечному підвищенню тиску.
Які побутові аналоги посудини Дьюара ми використовуємо в щоденному житті?
Найвідоміший аналог — це термос, який працює за тим же принципом.
Оцініть матеріал
Натисніть на зірку для оцінки:
Коментарі
Залишити відповідь:
Ваша e-mail адреса не оприлюднюватиметься