3.2. Дайте відповіді на запитання
У яких одиницях вимірюють відносну атомну масу?
Відносна атомна маса є безрозмірною величиною (, тому що це відношення маси атома до 1/12 маси атома Карбону-12, тобто двох величин з однаковою розмірністю).
Чому відносну атомну масу не вимірюють у кілограмах?
Тому що атоми — надзвичайно маленькі частинки. Їхня маса настільки крихітна (близько 10⁻²² г), що вимірювати її у кілограмах було б дуже незручно через дуже малі числа.
У яких одиницях вимірюють відносну молекулярну й формульну маси?
Відносні молекулярна та формульна маси є безрозмірними величинами (вони показують, у скільки разів маса молекули або формульної одиниці більша за атомну одиницю маси)
Для яких речовин використовують поняття «відносна формульна маса»?
Поняття «відносна формульна маса» використовують для речовин немолекулярної будови, наприклад, для іонних сполук.
3.4. Запишіть наведені хімічні елементи в порядку збільшення відносної атомної маси
B, N, F, Ne, S, Cl, K, Ca, Fe, Zn.
3.5. За наведеним зразком визначте, атом якого хімічного елемента важчий та у скільки разів.
Нітрогену чи Гелію: Ar(N)>Ar(He); Ar(N)/Ar(He)=14/4=3.5.
Оксигену чи Сульфуру: Ar(S)>Ar(O); Ar(S)/Ar(O)=32/16=2
Феруму чи Силіцію: Ar(Fe)>Ar(Si); Ar(Fe)/Ar(Si)=56/28=2
Карбону чи Купруму: Ar(Cu)>Ar(C); Ar(Cu)/Ar(C)=64/12≈5.33
Кальцію чи Натрію: Ar(Ca)>Ar(Na); Ar(Ca)/Ar(Na)=40/23≈1.74
Нітрогену чи Літію: Ar(N)>Ar(Li); Ar(N)/Ar(Li)=14/7=2
Сульфуру чи Купруму: Ar(Cu)>Ar(S); Ar(Cu)/Ar(S)=64/32=2
3.6. За наведеним зразком порівняйте маси зазначеного числа атомів хімічних елементів.
2 атоми Купруму чи 10 атомів Карбону: 2⋅Ar(Cu)=2⋅64=128>10⋅Ar(C)=10⋅12=120
4 атоми Оксигену чи 3 атоми Фосфору: 4⋅Ar(O)=4⋅16=64<3⋅Ar(P)=3⋅31=93
6 атомів Силіцію чи 3 атоми Хрому: 6⋅Ar(Si)=6⋅28=168>3⋅Ar(Cr)=3⋅52=156
2 атоми Мангану чи 10 атомів Силіцію: 2⋅Ar(Mn)=2⋅55=110<10⋅Ar(Si)=10⋅28=280
4 атоми Флуору чи 3 атоми Неону: 4⋅Ar(F)=4⋅19=76>3⋅Ar(Ne)=3⋅20=60
6 атомів Аргентуму чи 3 атоми Меркурію: 6⋅Ar(Ag)=6⋅108=648>3⋅Ar(Hg)=3⋅200=600
3.8. Складіть діаграми Венна, порівнявши поняття:
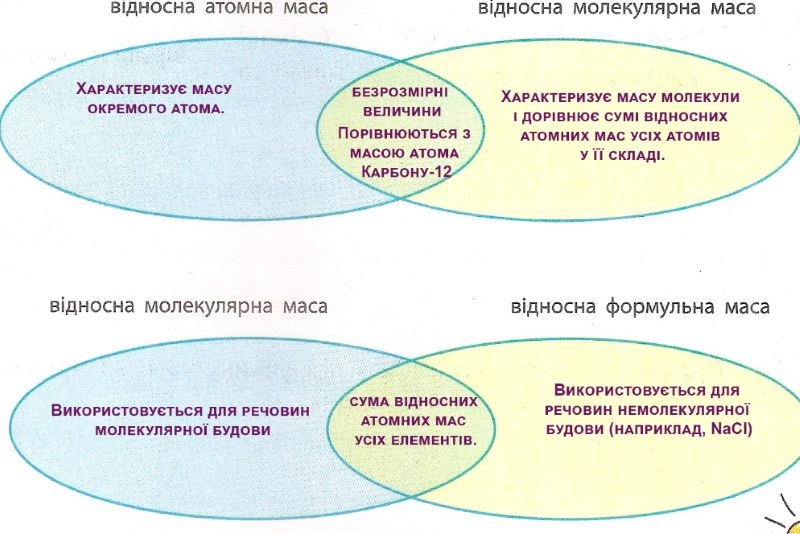
3.9. Обчисліть і запишіть відносні молекулярні (формульні) маси речовин.
- Mr(Cl2)=2⋅35.5=71
- Mr(CaO)=40+16=56
- Mr(H2S)=2⋅1+32=34
- Mr(CaSO4)=40+32+4⋅16=136
- Mr(CaCO3)=40+12+3⋅16=100
- Mr(H2SO4)=2⋅1+32+4⋅16=98
- Mr(K2SO4)=2⋅39+32+4⋅16=174
- Mr(Na3PO4)=3⋅23+31+4⋅16=164
- Mr(Cu(NO3)2)=64+2⋅(14+3⋅16)=188
- Mr(Cr2(SO4)3)=2⋅52+3⋅(32+4⋅16)=392
- Mr(Ag(NH3)2OH)=108+2⋅(14+3⋅1)+16+1=159
3.10. Визначте хімічні формули речовин за числом атомів Карбону й Гідрогену в їхніх молекулах та обчисліть відносні молекулярні маси речовин.
| Число атомів у молекулі | | Хімічна формула | Відносна молекулярна маса |
|---|
| Карбону | Гідрогену | | |
| 1 | 4 | CH₄ | CH4,Mr=12+4⋅1=16 |
| 2 | 6 | C₂H₆ | C2H6,Mr=2⋅12+6⋅1=30 |
| 3 | 8 | C₃H₈ | C3H8,Mr=3⋅12+8⋅1=44 |
| 4 | 10 | C₄H₁₀ | C4H10,Mr=4⋅12+10⋅1=58 |
| 6 | 6 | C₆H₆ | C6H6,Mr=6⋅12+6⋅1=78 |
3.11. Прочитайте завдання № 22 у підручнику на с. 31. Визначте й запишіть хімічну формулу перекису водню.
За умовою на один атом Оксигену припадає один атом Гідрогену, тому можлива формула HO
Але відносна молекулярна маса HO=1+16=17, а за умовою має бути 34.
Тому формула перекису водню H2O2, де Mr=2⋅1+2⋅16=34
3.12. Прочитайте завдання № 23 у підручнику на с. 31. Визначте й запишіть хімічну формулу піриту.
Нехай формула піриту FexSy. Атомні маси: Ar(Fe)=56, Ar(S)=32. Перевіримо різні співвідношення:
- FeS:56+32=88 (не підходить)
- FeS2:56+2⋅32=56+64=120 (підходить)
Формула піриту FeS2
3.13. Прочитайте завдання № 24 у підручнику на с. 31. Визначте й запишіть відносну молекулярну масу жасмоналю.
Спочатку визначимо загальну кількість атомів кожного елемента у сполуці:
- Карбон (C): 6+1+1+5+1=14
- Гідроген (H): 5+1+11+1=18
- Оксиген (O): 1
Загальна формула — C14H18O.
Відносна молекулярна маса Mr(C14H18O)=14⋅Ar(C)+18⋅Ar(H)+1⋅Ar(O)=14⋅12+18⋅1+16=168+18+16=202
