· Ілля Добрий · ГДЗ · 4 хв. читати
10. Кисень – єдиний газ повітря, що підтримує горіння - відповіді Григорович
Вправа 10.2 Схарактеризуйте хімічні властивості кисню.
| Хімічні рівняння | Ознаки взаємодії |
|---|---|
| Взаємодія з простими речовинами | |
| C + O₂ = CO₂↑ | тьмяно-червоне світіння |
| S + O₂ = SO₂↑ | тьмяно-синє полум’я |
| 4Р + 5O₂ = 2Р₂O₅ | білий задушливий дим |
| 2Mg + O₂ = 2MgO | виділення теплоти і світла |
| 4Fe + 3O₂ = 2Fe₂O₃ | розкидаються яскраві іскри |
| Взаємодія зі складними речовинами | |
| СН₄ + 2O₂ = СO₂ + 2Н₂O | яскраве полум’я, утворення води — у вигляді пари. Виділення теплоти й світла |
| 2H₂S + 3O₂ = 2SO₂ + 2Н₂O | Виділення теплоти й світла, має характерний їдкий запах. Зникнення запаху сірководню |
Вправа 10.3. Запишіть формули сполук.
- а) барій оксид: BaO
- б) хром(III) оксид: Cr₂O₃
- в) плюмбум(IV) оксид: PbO₂
- г) купрум(I) оксид: Cu₂O
- д) йод(V) оксид: I₂O₅
- е) станум(II) оксид: SnO
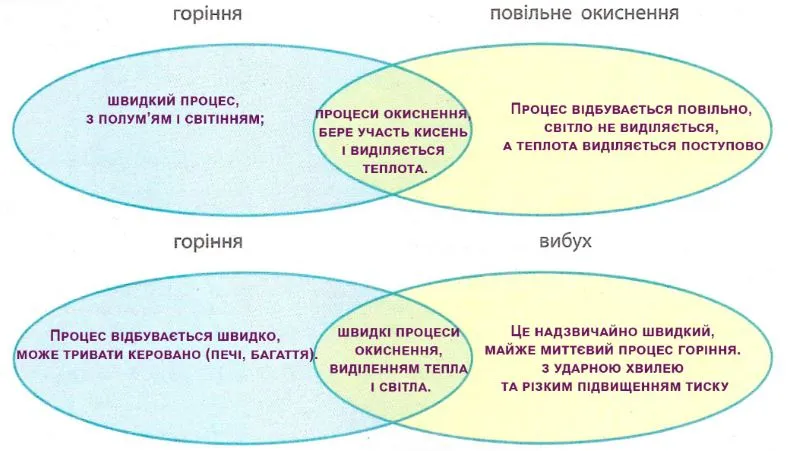
Вправа 10.5. Складіть діаграми Венна, порівнявши поняття:
Вправа 10.6. Підпишіть складники трикутнику вогню та дайте відповіді на запитання»
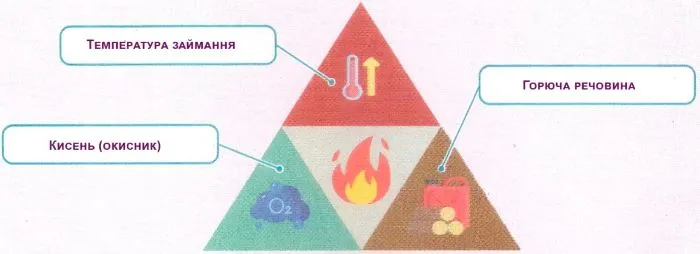
1. Які необхідні умови виникнення горіння?
Наявність горючої речовини, доступу повітря і нагрівання до температури займання.
2. За яких умов горіння може припинитися?
Якщо усунути одну з умов: перекрити доступ повітря або охолодити речовину.
3. Як можна визначити способи гасіння полум’я. Наведіть приклади.
- Охолодження: залити водою (але не бензин чи електроприлади).
- Перекриття доступу кисню: накрити ковдрою, засипати піском.
Вправа 10.7. Запишіть рівняння реакцій із киснем простих речовин:
- а) літію: 4Li + O₂ = 2Li₂O
- б) кальцію: 2Ca + O₂ = 2CaO
- в) силіцію: Si + O₂ = SiO₂
- г) фосфору: 4P + 5O₂ = 2P₂O₅
Вправа 10.8 Рівняння реакцій утворення оксидів:
- а) нітроген(II) оксиду: N₂ + O₂ = 2NO
- б) сульфур(IV) оксиду: S + O₂ = SO₂
- в) фосфор(III) оксиду: 4P + 3O₂ = 2P₂O₃
Вправа 10.9 Кросворд.
- Продукти згоряння простих речовин у кисні: ОКСИДИ
- Речовина, що підтримує горіння: КИСЕНЬ
- Англійський хімік, який першим виявив кисень: ПРІСТЛІ
- Процес за участі кисню, що відбувається без полум’я: ОКИСНЕННЯ
- Процес за участі кисню, що супроводжується виділенням теплоти і світла: ГОРІННЯ
- Найбільше сховище води на Землі: ОКЕАН
- Хімічний елемент у складі вуглекислого газу: КАРБОН
Ключове слово: Оксиген.
Вправа 10.10. Чадний газ (карбон(ІІ) оксид) добре горить з утворенням вуглекислого газу (карбон(ІУ) оксиду). Запишіть рівняння цієї реакції.
2CO + O₂ = 2CO₂
Вправа 10.11. Нітроген(ІІ) оксид легко окиснюється киснем з утворенням нітроген(ІУ) оксиду. Запишіть рівняння цієї реакції.
2NO + O₂ = 2NO₂
Вправа 10.12. Запишіть рівняння реакцій горіння наведених складних речовин, якщо під час їх згоряння утворюються по два оксиди.
- а) CH₄ + 2O₂ = CO₂ + 2H₂O
- б) 2C₂H₆ + 7O₂ = 4CO₂ + 6H₂O
- в) SiH₄ + 2O₂ = SiO₂ + 2H₂O
- г) 2C₆H₁₂O₅ + 13O₂ = 12CO₂ + 12H₂O
- д) C₂H₅OH + 3O₂ = 2CO₂ + 3H₂O
- е) 2PH₃ + 4O₂ = P₂O₅ + 3H₂O
Вправа 10.13 Скільки часу людина може прожити без кисню? Як ви вважаєте чому? Відповідь обґрунтуйте.
Зазвичай не більше 3-5 хвилин. Він бере участь у процесі клітинного дихання, під час якого виробляється енергія, необхідна для роботи всіх органів. Відсутність кисню призводить до гіпоксії, яка швидко викликає серйозні ушкодження мозку.
Вправа 10.14. Під час виконання важкої фізичної праці дихання людини стає частішим і глибшим. Поясніть чому.
Під час фізичних навантажень м’язи потребують більше кисню для вироблення енергії.
Вправа 10.15. Виправте помилки в хімічних рівняннях.
- а) 2H₂S + 3O₂ = 2SO₂ + 2H₂O
- б) CuO + 2HCl = CuCl₂ + H₂O
- в) 2ZnS + 3O₂ = 2ZnO + 2SO₂
- г) Ca + Br₂ = CaBr₂
- д) N₂ + O₂ = 2NO
- е) 2H₂ + O₂ = 2H₂O
Вправа 10.16. Дві речовини (аргентум(1+) оксид і меркурій(2+) оксид) за нагрівання розкладаються з утворенням простих речовин. Запишіть хімічні рівняння розкладу цих речовин. Обчисліть масові частки Оксигену в цих речовинах і зробіть висновок: яку з них вигідніше використовувати для одержання кисню.
Рівняння реакцій розкладу:
Масова частка Оксигену () в аргентум(I) оксиді ():
Масова частка Оксигену в меркурій(II) оксиді ():
Висновок: для одержання кисню вигідніше використовувати меркурій(II) оксид, оскільки масова частка Оксигену в ньому більша.
Вправа 10.17. Унаслідок згоряння сірковуглецю CS2 утворюються карбон(ІУ) оксид і сульфур(ІУ) оксид. Обчисліть масу використаного кисню, якщо одержали сульфур(ІУ) оксид масою 19,2 г.
Дано:
г.
Знайти:
- ?
Розв’язання:
г/моль.
г/моль.
моль.
За рівнянням реакції,
моль.
г.
Відповідь: маса використаного кисню 14,4 г.
Вправа 10.18. Обчисліть масу (г) сірки, яка згоріла, якщо було витрачено кисень масою 11,2 г.
Обчисліть масу кисню, необхідного для повного згоряння метану СН4 масою 4 г.
Дано:
г.
Знайти:
- ?
Розв’язання:
г/моль.
моль.
За рівнянням
моль.
г.
Відповідь: маса сірки, що згоріла б 11,2 г.
Вправа 10.19. Обчисліть масу кисню, необхідного для повного згоряння метану СН4 масою 4 г.
Дано:
г.
Знайти:
- ?
Розв’язання:
г/моль.
г/моль.
моль.
За рівнянням,
моль.
г.
Відповідь: для згоряння 4 г метану необхідно 16 г кисню.
Вправа 10.20. Установіть взаємозв’язок між властивостями кисню та галузями його застосування.
| Властивості кисню | Галузь застосування |
|---|---|
| Підтримує дихання | Медицина (для пацієнтів із проблемами дихання), авіація (для дихання на великих висотах), підводне плавання (для дихальних апаратів водолазів). |
| Підтримує горіння | Металургія та скловаріння (для досягнення вищих температур у печах), зварювання та різання металів, як окисник у ракетному паливі. |
Вправа 10.21. Доповніть схему «Застосування кисню».
- Живі організми: для дихання клітин і тканин організмів.
- У медицині: Для дихальних апаратів (кисневих подушок).
- У ракетній техніці: Як окисник для ракетного палива.
- У двигунах внутрішнього згоряння: Забезпечує згоряння пального.
- У металургії: Для виплавки сталі та чавуну (інтенсифікує горіння та підвищує температуру полум’я).
- Ваші приклади: Зварювання, тяга в димоході підтримує горіння в печі
Оцініть матеріал
Натисніть на зірку для оцінки:
Коментарі
Залишити відповідь:
Ваша e-mail адреса не оприлюднюватиметься