· Ілля Добрий · ГДЗ · 5 хв. читати
§ 31. Будова молекул простих речовин. Ковалентний зв’язок
ДІЗНАЄТЕСЯ, ЗРОЗУМІЄТЕ, ВИКОРИСТАЄТЕ
Чому електронні оболонки атомів кількох хімічних елементів є найстійкішими?
Електронні оболонки інертних елементів є найстійкішими, оскільки вони мають повністю заповнений зовнішній енергетичний рівень. Він складається з восьми електронів (електронний октет) або двох електронів у випадку Гелію ().
Як однакові атоми сполучаються в молекули?
Однакові атоми неметалічних елементів сполучаються в молекули шляхом зближення та перекривання їхніх електронних орбіталей, унаслідок чого утворюються спільні електронні пари.
Який зв’язок між атомами називають простим, подвійним, потрійним?
Простим називають ковалентний зв’язок, який реалізується за допомогою однієї спільної пари електронів, подвійним — за допомогою двох пар, а потрійним — трьох спільних пар електронів.
Як складають електронні та графічні формули молекул?
В електронних формулах молекул кожен електрон зовнішнього рівня позначають крапкою біля символу елемента. У графічних формулах кожну спільну пару електронів, що утворює хімічний зв’язок, зображують рискою.
Запишіть електронну формулу атома Гідрогену та зобразіть її графічний варіант.
Електронна формула атома Гідрогену має вигляд . Її графічний варіант зображують як одну квадратну комірку (s-орбіталь) з однією стрілкою вгору, що позначає неспарений електрон:
Чому молекула водню складається з двох, а не більшої кількості атомів?
Молекула водню () складається з двох атомів, тому що кожен атом Гідрогену має на зовнішньому рівні один електрон і потребує ще одного для його завершення. При сполученні двох атомів утворюється одна спільна електронна пара, що дозволяє обом атомам отримати стійку двоелектронну оболонку, подібну до оболонки інертного елемента Гелію ().
Чим відрізняється повна електронна формула молекули від спрощеної?
Повна електронна формула молекули відображає всі електрони зовнішніх енергетичних рівнів обох атомів, включаючи спільні пари та неподілені електронні пари (ті, що не брали участі в утворенні зв’язку). Спрощена електронна формула показує лише спільні електронні пари, які зумовлюють хімічний зв’язок між атомами.
Складіть електронну формулу атома Нітрогену і зобразіть її графічний варіант. Cкільки неспарених електронів у цьому атомі?
Електронна формула атома Нітрогену — .
Графічний варіант для зовнішнього рівня:
У цьому атомі є три неспарені електрони на -підрівні.
Складіть повну електронну формулу молекули азоту.
Повна електронна формула молекули азоту () має вигляд:
.. ..
:N ≡ N:
У цій формулі три пари крапок між символами елементів позначають три спільні електронні пари (потрійний зв’язок), а пари крапок з боків — власні неподілені електронні пари кожного атома Нітрогену.
ВИОКРЕМЛЮЄМО ОСНОВНЕ
Проаналізувавши матеріал, викладений у параграфі, запишіть у зошиті висновки про те, електронні оболонки якого складу забезпечують стійкість атомів і як сполучені атоми в молекулах неметалів.
Найбільш стійкими є електронні оболонки, які містять вісім електронів на зовнішньому рівні (електронний октет), а для першого періоду — два електрони. Атоми в молекулах неметалів сполучаються ковалентним зв’язком шляхом утворення спільних електронних пар із їхніх неспарених електронів.
Сформулюйте цікаве запитання за темою параграфа і поставте його своїм однокласникам / однокласницям. Порівняйте свою і їхні відповіді та оцініть їх. Поясніть, чому ваша оцінка саме така.
Запитання: «Чому атоми Гідрогену утворюють молекулу , а атоми Гелію залишаються поодинці?»
Моя відповідь: Це відбувається тому, що атом Гідрогену має незавершену оболонку з одного електрона () і прагне її добудувати до стійкого стану (). Атом Гелію вже має завершену стійку двоелектронну оболонку (), тому не утворює зв’язків.
Оцінка: Моя відповідь базується на електронній будові атомів, що є науковим поясненням хімічної активності або інертності елементів.
ВАШІ ДОСЯГНЕННЯ І ВІДКРИТТЯ
Який зв’язок називають ковалентним? Яка особливість електронної будови атомів, між якими утворюється цей зв’язок?
Ковалентним називають хімічний зв’язок, який виникає між атомами завдяки утворенню спільних електронних пар. Особливістю будови таких атомів є наявність на їхніх зовнішніх енергетичних рівнях неспарених електронів, які вони використовують для досягнення стійкого восьмиелектронного (або двоелектронного) стану.
Охарактеризуйте зв’язок у молекулі . Назвіть орбіталі атомів Хлору, які зазнають перекривання.
Зв’язок у молекулі є ковалентним простим (одинарним), оскільки атоми утримуються однією спільною парою електронів. У процесі утворення зв’язку відбувається перекривання -орбіталей атомів Хлору, на яких розташовані неспарені електрони.
З якою кількістю атомів сполучений кожний атом у молекулі білого фосфору? Простими, подвійними чи потрійними є ковалентні зв’язки між атомами в молекулі ?
У молекулі білого фосфору , яка має форму тетраедра, кожен атом Фосфору сполучений із трьома іншими атомами. Ковалентні зв’язки між атомами в молекулі є простими.
ВИКОНАЙМО ВПРАВУ
Складіть повну і спрощену електронні формули молекули та зобразіть графічну формулу цієї молекули.
Повна електронна формула (відображає всі зовнішні електрони):
.. ..
:F: — :F:
.. ..
Спрощена електронна формула (відображає лише спільну пару):
F : F
Графічна формула:
F - F
ПОМІРКУЙМО
У молекулі кисню чи в молекулі азоту зв’язок між атомами, на вашу думку, має бути міцнішим? Правильність відповіді перевірте, відшукавши в інтернеті відомості про умови, за яких кожна молекула розпадається на атоми.
Зв’язок у молекулі азоту () є міцнішим, оскільки атоми Нітрогену сполучені потрійним ковалентним зв’язком (), тоді як атоми Оксигену в молекулі кисню () — лише подвійним (). Довідкові дані підтверджують це: молекула азоту є надзвичайно стійкою і починає розпадатися на атоми лише за дуже високих температур (понад ), тоді як молекула кисню дисоціює легше.
СТВОРЮЙМО
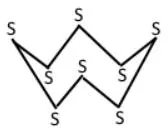
Зобразіть графічну формулу молекули , якщо кожний атом у ній сполучений з двома іншими простими ковалентними зв’язками.
Графічна формула молекули сірки являє собою замкнене кільце у формі «корони», де вісім атомів Сульфуру послідовно з’єднані між собою одинарними рисками:
ФОРМУЙМО СЛОВНИЧОК
Випишіть ключові слова і словосполучення з тексту параграфа для укладання двомовного словничка.
- Ковалентний зв’язок — covalent bond
- Спільна електронна пара — shared electron pair
- Електронна формула — electron formula
- Графічна (структурна) формула — graphic (structural) formula
- Простий (одинарний) зв’язок — single bond
- Подвійний зв’язок — double bond
- Потрійний зв’язок — triple bond
- Електронний октет — electron octet
- Неспарені електрони — unpaired electrons
- Інертні елементи — inert elements
ОЦІНЮЙМО СВОЇ ЗНАННЯ
Створіть у зошиті таблицю оцінювання ваших знань і заповніть її.
| Знання та вміння | Оцінка |
|---|---|
| Розумію механізм утворення ковалентного зв’язку | Засвоєно |
| Вмію складати електронні формули молекул | Засвоєно |
| Розрізняю типи ковалентних зв’язків за кратністю (простий, подвійний, потрійний) | Засвоєно |
| Вмію будувати графічні формули молекул простих речовин | Потребує практики |
| Розумію причину хімічної пасивності інертних газів | Засвоєно |
Оцініть матеріал
Натисніть на зірку для оцінки:
Коментарі
Залишити відповідь:
Ваша e-mail адреса не оприлюднюватиметься